一、法规要求:为什么必须验证人员资质?
在药品、医疗器械等受GMP监管的行业,“经过培训并具备资质的合格人员”是保障产品质量的第一道防线。主要法规依据包括:
-
《药品生产质量管理规范》(GMP):明确要求企业应当配备足够数量并具有适当资质的人员,从事药品生产和质量管理。关键操作应由经过授权且有书面记录证明已接受相应培训的人员承担。
-
《医疗器械生产质量管理规范》:强调企业应建立人员档案,保存相关教育、培训、技能和经验的记录,确保人员能力与岗位要求相匹配。
-
FDA 21 CFR Part 211及欧盟GMP附录:均对人员资格、培训和职责有明确规定,要求通过记录证明其持续胜任力。
核心精神: 法规不仅要求员工具备资质,更要求在执行特定任务时,能实时、客观地验证其资质是否有效,确保“正确的人做正确的事”,所有操作可追溯、可审计。
二、系统实现:三步构建“资质-流程”合规闭环
您的GMPEBR系统通过以下三个核心界面,完美实现了上述法规要求。
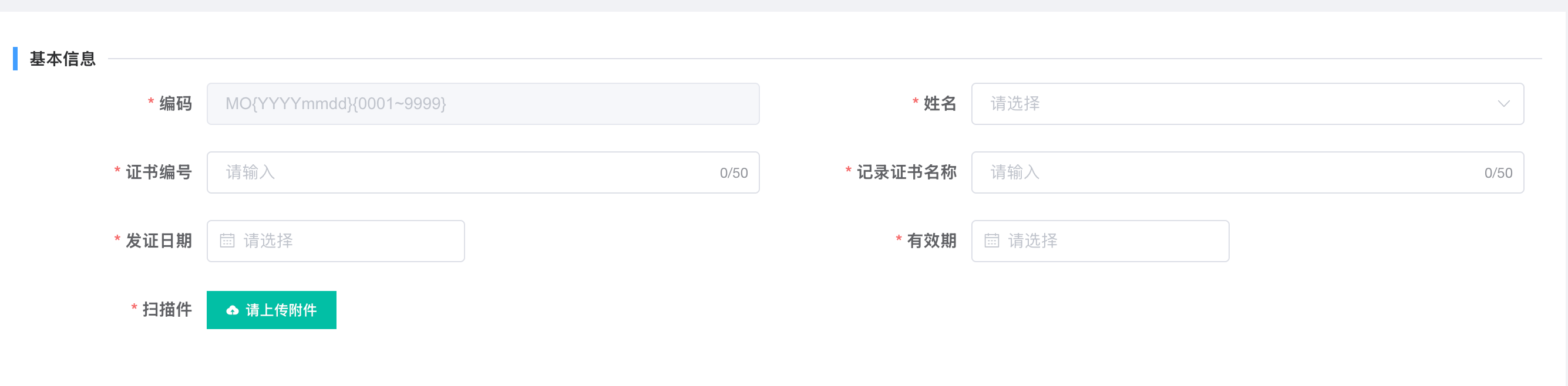
第一步:定义并录入人员资质(基础档案建立)
-
功能解读:此界面是建立全体人员电子资质档案的入口。
-
合规映射:
-
编码与证书编号:确保每份资质有唯一、可追溯的标识。
-
姓名、发证日期、有效期:明确了“谁”、“何时取得”、“何时失效”,系统可据此自动进行有效期动态管理。
-
上传附件:保存官方证书扫描件,为审计提供直观的原始证据。
-
-
操作意义:将所有分散的纸质证书转化为结构化、可检索的数据库,是后续一切自动验证的基础。
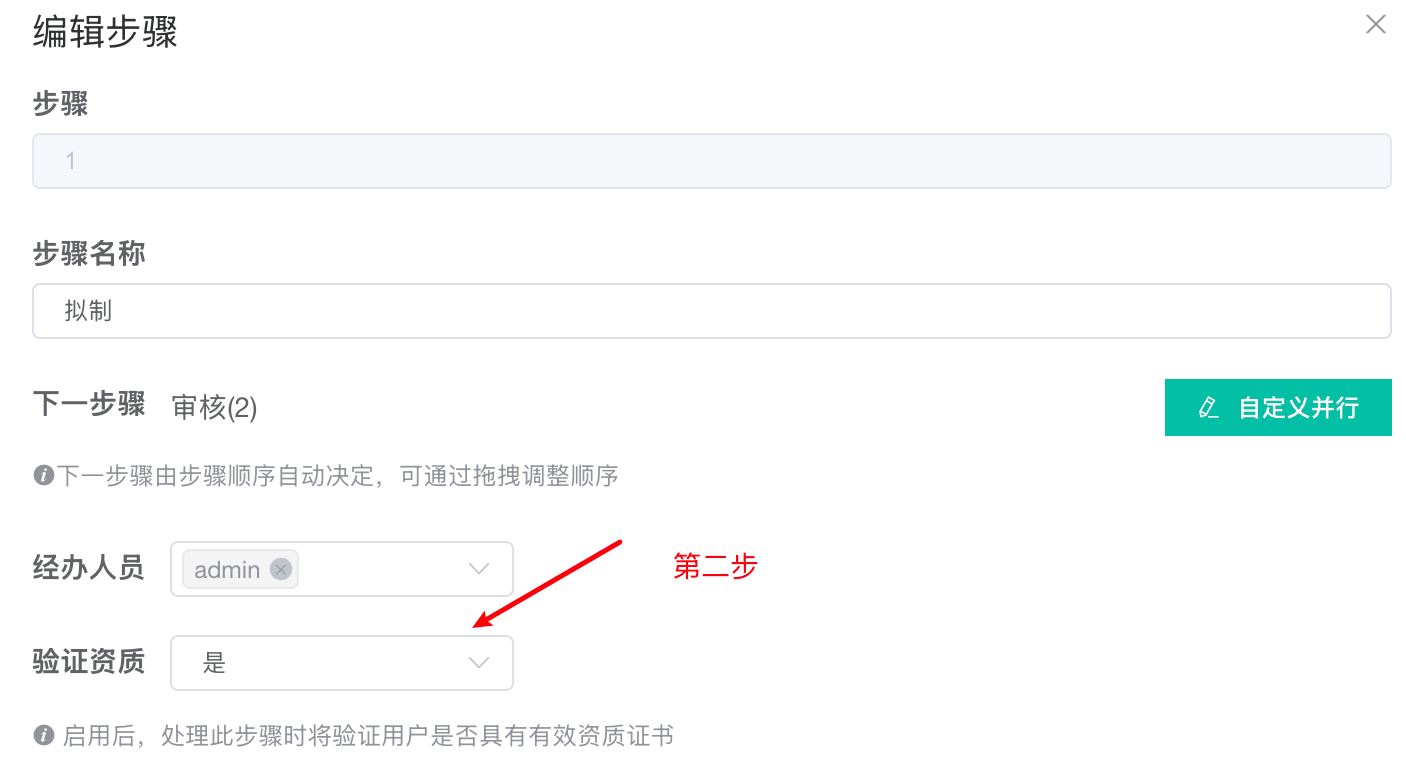
第二步:在工作流节点中绑定资质要求(规则设定)
对应您上传的第一张图
-
功能解读:在配置工作流(如“注射器批记录”)的每一步时,可设定具体的资质门槛。
-
合规映射:
-
步骤名称:对应具体的操作活动(如“拟制”、“清洁消毒”)。
-
验证资质:是:这是核心开关。启用后,系统将强制验证。
-
经办人员 & 验证资质关联:虽然此处可预设经办人,但真正的约束力在于系统会检查该预设人员(或后续实际处理人)的资质档案中,是否具备执行此步骤所必需的有效证书。
-
-
操作意义:将法规对岗位的抽象要求,转化为系统中一个个具体的、可执行的验证规则,确保流程设计阶段即嵌入合规基因。
第三步:任务执行时的实时验证与拦截(规则执行)
-
正常验证场景:
对应您上传的第三张图
-
界面提示“需验证资质”:明确告知当前步骤的合规属性。
-
当用户
admin尝试处理时,系统后台自动查询其资质档案,匹配成功则允许操作。
-
-
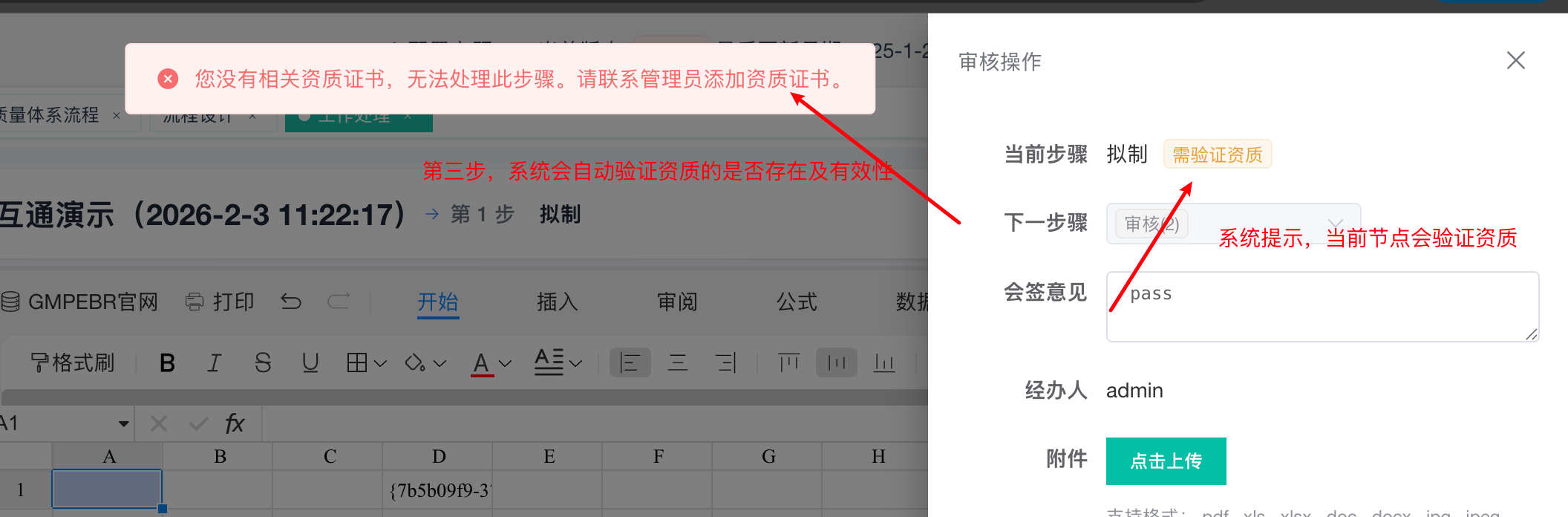
验证失败场景:
对应您上传的第四张图
-
系统弹出明确警告:“您没有相关资质证书,无法处理此步骤。”
-
强制拦截:无论用户是否知晓,系统均阻止流程继续进行,从技术上杜绝了无资质操作的可能。
-
引导解决:提示“请联系管理员添加资质证书”,形成管理闭环。
-
三、价值总结:超越纸质的智能化合规
将人员资质与体系流程绑定,您的系统实现了从“静态档案管理”到“动态过程控制”的跨越,为客户带来三重核心价值:
|
维度 |
传统纸质管理 |
您的GMPEBR系统 |
价值提升 |
|---|---|---|---|
|
合规保证 |
依赖人员自觉和事后检查,易出现漏洞。 |
系统强制实时验证,无有效资质则无法操作,实现主动防御。 |
从根本上降低合规风险,轻松应对飞检。 |
|
追溯效率 |
出问题时,需人工翻找大量纸质档案,耗时耗力。 |
一键关联。在批记录中直接点击经办人姓名,即可查看其所有资质证书和培训记录。 |
实现“人-事-证”分钟级穿透追溯,满足法规对可追溯性的最高要求。 |
|
管理效能 |
资质到期、培训计划需人工提醒,易遗漏。 |
系统自动监控,资质临期自动预警,驱动培训与再认证流程。 |
变被动管理为主动、精准的合规资源调度,提升整体质量体系运行效率。 |
四、最佳实践建议
-
资质颗粒度:建议将资质划分到足够细的维度,例如:“无菌灌装操作资格”、“HPLC检测上岗证”、“设备A单独操作授权”等,以实现最精准的验证。
-
定期回顾:利用系统的预警功能,建立季度或半年度的资质回顾机制,确保持续合规。
-
审计准备:在应对审计时,可直接演示“如何为一个关键步骤配置资质要求”以及“当无资质人员尝试操作时系统如何拦截”,这是证明您质量体系控制有效性的最佳实证。