一、法规要求:为什么必须记录数据修改痕迹?
在GMP(药品生产质量管理规范)体系中,数据完整性的核心原则是 ALCOA+,其中关键的两项要求直接对应差异对比功能:
-
A - Attributable(可归因性):任何数据的创建、修改或删除都必须记录操作人。
-
C - Contemporaneous(同步性):操作必须在执行时实时记录。
-
T - Traceable(可追溯性):必须能追溯数据的完整历史,包括所有更改。
-
法规依据:
-
FDA 21 CFR Part 11:要求电子记录系统具备生成准确、完整的副本的能力,并能通过审计追踪,独立地记录操作者登录、创建、修改或删除电子记录的操作。
-
中国《药品记录与数据管理要求(试行)》:明确规定记录的任何修改都应当能够追溯到修改人、修改时间和修改原因,修改前的原信息应当清晰可辨。
-
欧盟GMP Annex 11:要求计算机化系统记录输入和确认关键数据的人员身份,审计追踪应记录数据的修改及理由。
-
核心要求:任何对批记录数据的修改,都不能被简单地覆盖。系统必须自动、不可篡改地记录“谁、在什么时候、从什么值改成了什么值、以及为什么改”。
二、系统实现:差异对比工具三步操作法
您的系统通过 “操作日志” -> “差异对比” -> “表单预览” 的闭环设计,完美实现了上述法规要求。以下结合截图逐步讲解。
第一步:定位与审查操作日志(发现修改行为)


-
场景:当您需要对某个批记录的修改历史进行审计时,首先进入该批记录的“操作日志”。
-
信息解读(表格是关键):
-
步骤与名称:精确定位到哪个工作流节点发生了操作。
-
内容:描述了操作行为(如“从步骤提炼1转发至步骤提炼2”),这是审计追踪的描述性记录。
-
状态、操作人、IP地址、操作时间:完整构成了 “可归因”与“同步” 的证据链。
-
操作列:这里的 “差异对比” 按钮,是进入详细数据修改痕迹分析的入口。
-
-
操作:点击需要审查的步骤(如步骤2“提炼2”)对应的 “差异对比” 按钮。
第二步:执行精确的差异对比(分析修改内容)
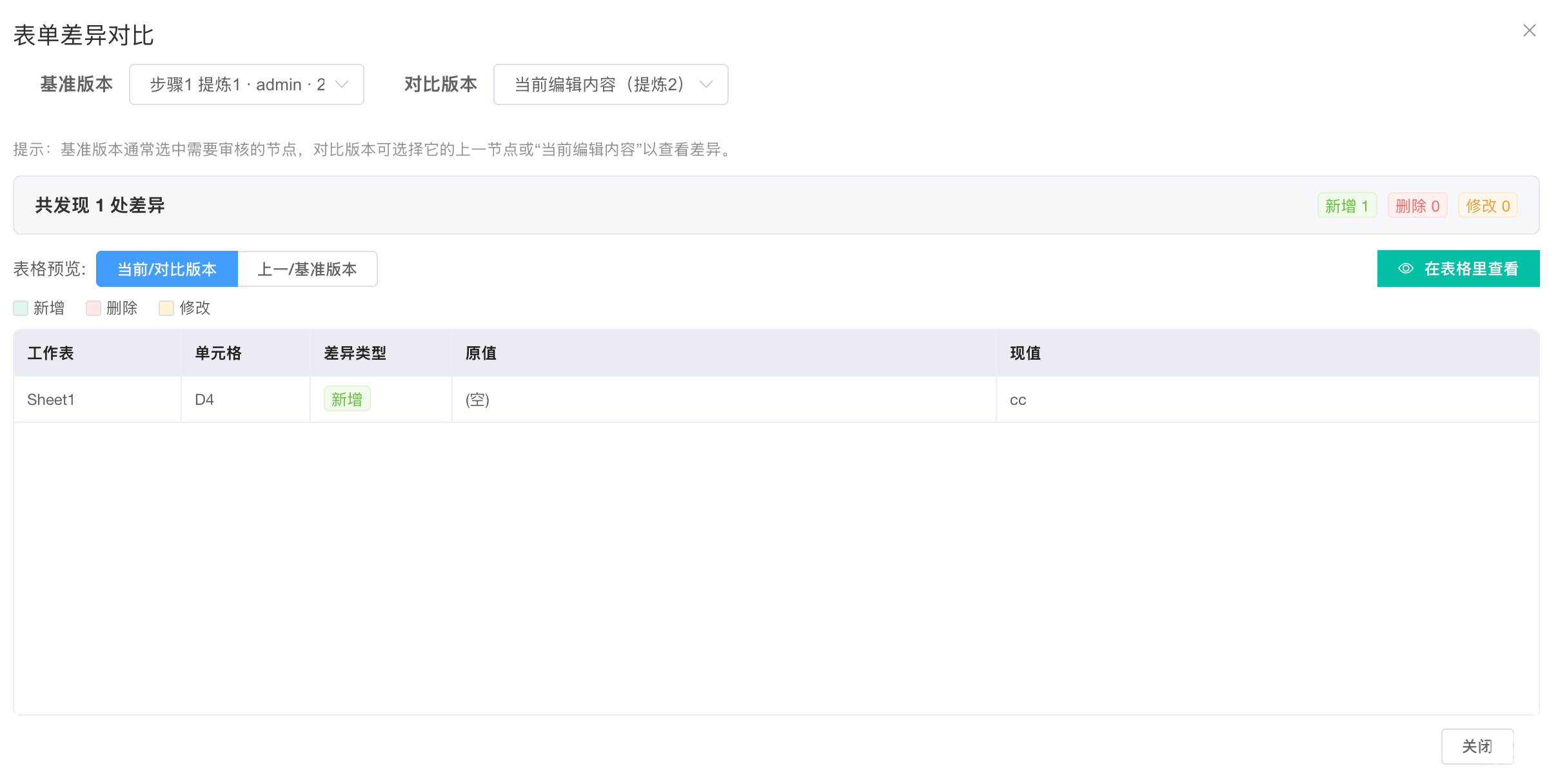
表单差异对比界面
-
功能核心:这是将法规要求的“修改痕迹”可视化、具体化的核心工具。
-
关键操作与解读:
-
选择基准版本:通常选择待审核节点的上一个已完成的版本(如图中“步骤1 提炼1”)。这是修改前的原始数据。
-
选择对比版本:选择 “当前编辑内容” 或下一个版本(如图中“当前编辑内容(提炼2)”)。这是修改后的数据。
-
自动分析:系统自动比对两个版本,以单元格为最小单位,识别出新增、删除、修改的具体内容。
-
示例:图中清晰显示,在单元格
D4处发生了 “新增” 操作,原值为空,现值变为了cc。 -
共发现1处差异:系统给出量化统计,确保审计者不会遗漏任何改动。
-
-
-
合规价值:这完美回答了审计员的提问:“这次修改,具体改动了哪些数据?” 避免了“数据被覆盖,无从查证”的致命缺陷。
第三步:可视化预览与确认(验证修改结果)
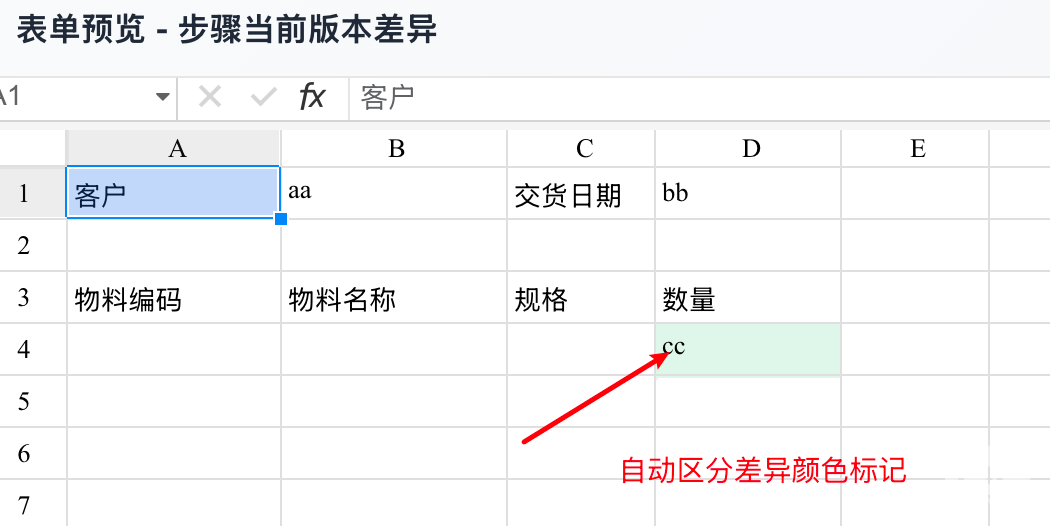
表单预览界面
-
功能延伸:在对比分析后,可通过“在表格里查看”或直接预览功能,直观查看差异在完整表单中的呈现。
-
信息解读:图中
D4单元格(即物料名称列,第四行)以绿色底色高亮显示,直观地标记了此处是当前版本与基准版本相比发生变动的位置。 -
操作闭环:确认差异后,可进行批准或退回等操作,所有行为将继续被记录在操作日志中。
三、合规价值总结:从“有记录”到“能证明”
|
传统纸质/简易电子记录 |
您的GMPEBR差异对比系统 |
产生的合规质变 |
|---|---|---|
|
修改时涂改或换页,原始信息丢失。 |
修改前的原值(如“空”)与修改后的现值(如“cc”)并列显示,原始数据永久保留。 |
满足“清晰可辨”的法规要求,修改无法抵赖。 |
|
仅记录“已修改”,但不知改了什么。 |
精确定位到工作表、单元格,并分类(增/删/改),修改内容一目了然。 |
实现“完全可追溯”,大幅提升内部调查和外部审计效率。 |
|
依赖人工记忆或备注说明修改原因。 |
与“操作日志”强关联,自动记录操作人、时间、IP,为追查修改原因提供完整上下文。 |
强化“可归因性”,形成坚实的电子证据链。 |
最佳实践建议:
-
定期审计:质量部门应定期(如每季度)使用此工具,随机抽查关键步骤记录的修改历史,作为内部审计的一部分。
-
偏差调查:任何与批记录相关的偏差(OOS/OOT)调查中,必须使用此工具分析相关记录是否被修改过,以及修改是否合规。
-
迎检演示:在药监局现场检查时,直接向检察官演示此功能,是证明您数据完整性控制措施有效的最佳方式之一。
通过本教程,我们可以看到您的系统不仅是一个记录工具,更是一个内嵌了主动合规防御机制的质量保证平台。差异对比工具将抽象的法规要求,转化为每个操作员、每次数据变动中具体、可见、可审计的合规行为。